恢复全身 GDF11 水平可逆转小鼠骨骼肌中与年龄相关的功能障碍
抽象的
联体共生实验表明,老年小鼠的再生受损可以通过暴露于年轻循环中来逆转,这表明年轻血液中含有可以恢复再生功能的体液“恢复活力”因子。在这里,我们证明循环蛋白生长分化因子 11 (GDF11) 是骨骼肌的恢复活力因子。通过异时共生或重组蛋白的全身递送,补充全身 GDF11 水平(通常随年龄增长而下降)逆转功能障碍并恢复衰老肌肉干细胞(卫星细胞)的基因组完整性。老年小鼠 GDF11 水平的增加也改善了肌肉结构和功能特征,并增加了力量和耐力运动能力。
骨骼肌是一种高度特化的组织,主要由可收缩的多核纤维组成,其损伤后的再生取决于称为“卫星细胞”的肌纤维相关单核干细胞特化亚群的活动。卫星细胞可以通过荧光激活细胞分选根据其独特的表面标志物特征 (CD45 − Sca-1 − CD11b − CXCR4 + β1-integrin + ) 进行分离,这有效地将它们与非生肌细胞和肌肉内分化程度更高的成肌细胞区分开来。
老化的肌肉表现出卫星细胞数量减少、卫星细胞功能受损和再生潜力降低 。要在评估中老化骨骼肌卫星细胞的功能每个细胞的基础上,我们进行了克隆肌生成测定,发现CD45 -的Sca-1 -细胞CD11b - CXCR4 + β1整合+卫星细胞从相比年轻细胞(形成到老龄小鼠的4倍更少菌落Fig.S2A。为了研究衰老肌肉中卫星细胞活性降低的分子基础,我们使用单细胞凝胶电泳分析检测了年轻和衰老卫星细胞的 DNA 完整性。新分选的卫星细胞显示出随着年龄的增长 DNA 损伤显着增加,约 60% 的老化细胞表现出严重受损的 DNA 完整性。同样,从老化肌肉中分选出来的近 60% 的卫星细胞或通过分离肌纤维上的 Pax7 染色鉴定,显示出对组蛋白 H2AX磷酸化形式的免疫反应性增加, DNA 损伤的标志物 。相比之下,40% 的新鲜分离的年轻卫星细胞没有通过凝胶电泳检测可检测到的 DNA 损伤,并且在细胞分选后检测时,年轻的卫星细胞核很少含有超过两个 pH2AX 病灶或在单个肌纤维上。X 辐射诱导的 DNA 损伤降低了移植试验中年轻卫星细胞的生肌功能,表明 DNA 损伤的增加可能导致衰老肌肉的再生受损。
先前的研究表明,衰老肌肉中受损的再生可以通过异时共生来逆转,它将衰老组织暴露在年轻的全身环境中,并通过上调 Notch 信号来恢复损伤诱导的卫星细胞激活。为了确定这种干预是否也恢复了老化卫星细胞的功能和基因组完整性,我们生成了异时性 parabionts(图 S5),将年轻的 C57BL/6 雄性(2 个月大)与老年伴侣(22 个月大)一起加入,并将这些与等时(年轻或老年)共生体对照进行比较。引人注目的是,与来自老年等时对照的卫星细胞相比,从加入年轻伙伴(以下称为“老年异时小鼠”)的老年小鼠中分选的卫星细胞显示出改善的生肌集落形成活性。来自老年异时性小鼠的卫星细胞也表现出恢复的基因组完整性,DNA 损伤评分与年轻等时性小鼠无法区分。图 1B) 和与老年等时小鼠相比减少的 pH2AX 病灶数量 。有趣的是,正如通过 BrdU 掺入评估的那样,这种基因组完整性的恢复并未伴随着卫星细胞增殖或增殖历史的可检测变化。
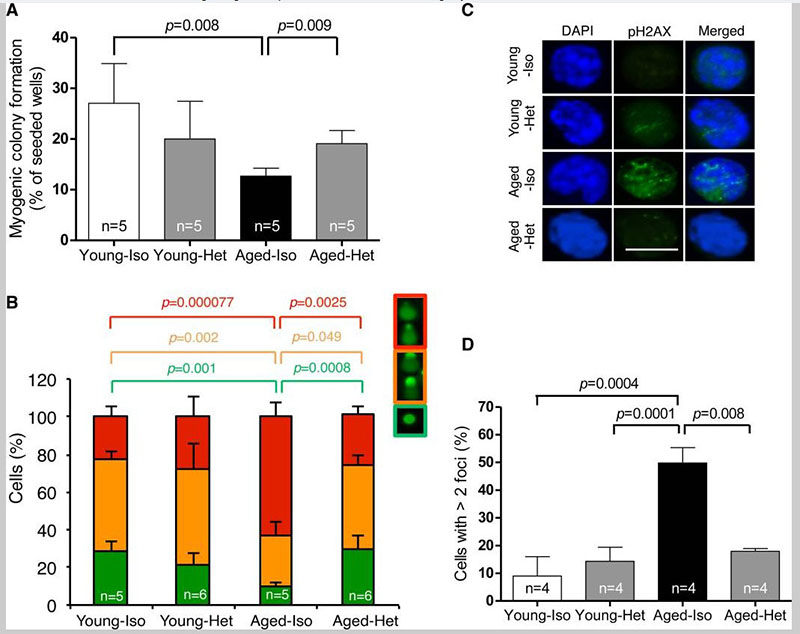
图1
异时共生使肌肉干细胞恢复活力
(一)。来自等时 (Iso) 或异时 (Het) 小鼠的克隆分选卫星细胞在培养 5 天后形成集落的频率。所有集落都显示出肌肉谱系细胞的特征形态。( B ) 在碱性条件下通过单细胞凝胶电泳评估新鲜分选的卫星细胞中的 DNA 损伤。使用视觉评分指标 (顶部的键)量化损坏并用颜色编码表示:无损坏(绿色)、中度损坏(橙色)、最大损坏(红色)。( C ) 用 DAPI (蓝色) 和抗 pH2AX (绿色) 染色的新鲜分选卫星细胞的代表性图像 (共焦 z 堆栈); 数据在(D)中量化。所有图表均表示平均值 ± SD,其中p-values,由 Mann-Whitney 分析计算。“n=”表示用于每次分析的小鼠数量。比例尺 = 10µm。
已经研究了几种生长因子和细胞因子作为肌肉生长和修复的潜在调节剂,包括转化生长因子-β1 (TGF-β1)、肌生长抑制素和 Wnt 样分子。我们最近报道了老年小鼠生长分化因子 11 (GDF11) 的全身水平下降,GDF11 是与肌生长抑制素 (MSTN) 同源的 TGF-β 超家族成员 。与 GDF11 相比,老年小鼠血浆中 MSTN 水平保持不变,TGF-β1 增加(图 S7A、B,左图)。老年小鼠肌肉中的 GDF11 水平也下降,而 TGF-β1 和 MSTN 水平未改变。
我们之前的研究表明,恢复更年轻的全身 GDF11 水平可以逆转与年龄相关的心脏肥大 。为了确定补充来自年轻伴侣的 GDF11 是否可能同样导致异时生物骨骼肌变化,我们每天腹膜内注射重组 GDF11(rGDF11,0.1mg/kg)治疗老年小鼠,以增加全身 GDF11 水平。4 周后,流式细胞仪测定的卫星细胞频率和函数在 rGDF11 处理的小鼠肌肉中增加,而其他肌纤维相关的单核细胞群不受影响。用 rGDF11 处理的老年小鼠也显示出具有完整 DNA 的卫星细胞数量增加。图 2C),与来自仅接受载体相同时间长度的老年小鼠的细胞相比。此外,用 rGDF11 处理后,新分离的 DNA 严重受损的卫星细胞的百分比降低了 4 倍(红色条,图 2C)。与在老年小鼠中获得的结果相反,用相同的 rGDF11 注射方案治疗的年轻小鼠未显示卫星细胞频率、肌源性集落形成或 DNA 损伤的变化。
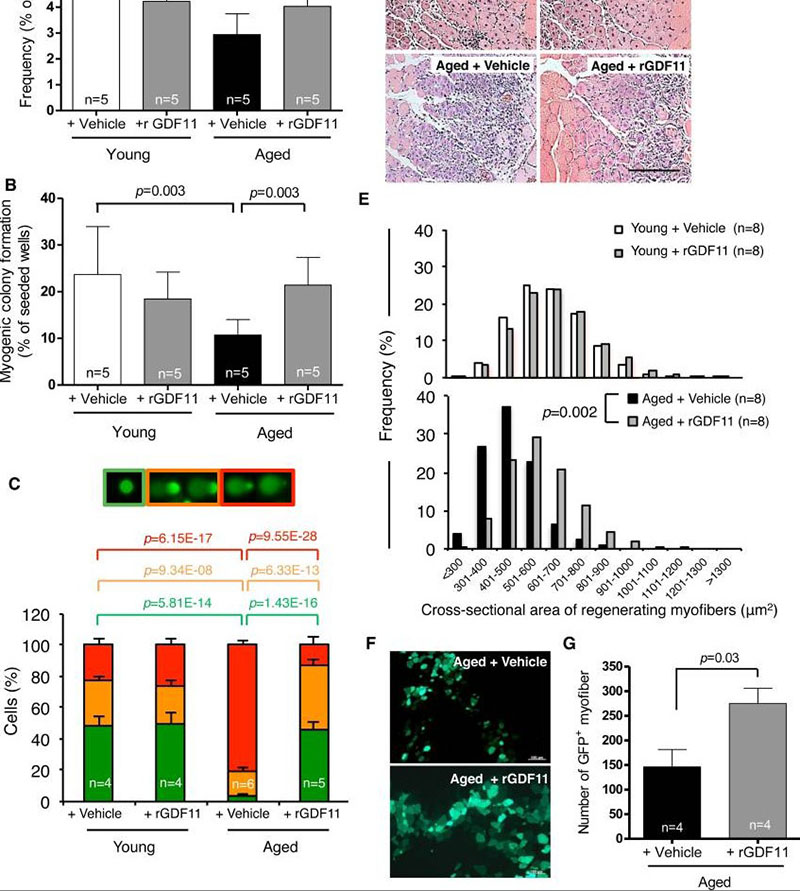
图2
通过补充 rGDF11 使肌肉干细胞恢复活力
(A, B)。来自载体或 rGDF11 处理的小鼠的卫星细胞的频率 ( A ) 和生肌集落形成 ( B )。(三)。使用来自媒介物或 rGDF11 处理的小鼠的新鲜分选的卫星细胞对 DNA 损伤测定进行量化,评分为图 1B. (D, E)。H&E 染色 ( D ) 和肌纤维大小 ( E ) 在冷冻损伤后 7 天再生 TA 肌肉中的频率分布,在媒介物或 rGDF11 处理的年轻和老年小鼠中。比例尺 = 100µm。( F )。移植后 2 周 TA 肌肉横向冷冻切片的代表性图像。( G ) 将移植数据量化为在每个移植肌肉中发现的最大数量的 GFP +肌纤维。图表代表平均值 ± SD(在 A-C、G 中)。p值通过 Mann-Whitney 分析 (A–C)、Wilcoxon Exact 分析 (E) 或 Student t检验 (G) 计算。“n=”表示用于每次分析的小鼠数量。
我们接下来通过伤害一组 rGDF11 治疗和对照小鼠来评估补充 rGDF11 对卫星细胞体内再生活性的影响。在胫骨前肌冷冻损伤前 28 天开始治疗,并在此后持续 7 天。值得注意的是,在老年小鼠中补充 rGDF11 可以恢复肌肉再生中更年轻的肌纤维口径。图 2D),并将这些动物中再生肌纤维的平均尺寸增加到年轻对照小鼠再生纤维尺寸的 92%。然而,补充 rGDF11 5 周并没有改变未受伤的年轻或年老肌肉的肌纤维口径。在老年小鼠中补充 rGDF11 也增强了移植模型中卫星细胞的再生能力,在移植模型中,将等量的 GFP 标记的卫星细胞注射到用 rGDF11 或单独载体治疗的老年动物的受伤肌肉中,分别在 4 周前和 2 周移植后。用 rGDF11 处理的受体显示出几乎是载体处理受体的两倍多的移植 (GFP + ) 纤维。rGDF11 治疗的受体中新再生的纤维口径也更大,这与 rGDF11 对老年小鼠肌肉损伤内源性修复的影响一致。
我们接下来询问了 rGDF11 对衰老肌肉影响的机制基础。虽然我们没有看到大体解剖结构、体重、脂肪量或肌肉量的变化,但免疫荧光分析表明,rGDF11 治疗后神经肌肉接头的大小增加。此外,未受伤肌肉的电子显微镜显示,用 rGDF11 治疗的老年小鼠的肌原纤维和线粒体形态显着改善。治疗后的肌肉显示出非典型和肿胀的线粒体减少,液泡的积累减少,并恢复了规则的肌节和纤维间线粒体模式。与这些超微结构的改善相一致,过氧化物酶体增殖物激活受体 γ 共激活因子 1α (PGC-1α) 是线粒体生物发生的主要调节因子,在 rGDF11 治疗的老年小鼠的肌肉中水平增加。图 3B),表明 GDF11 可能影响裂变和融合的线粒体动力学,以产生新的线粒体。与这一观点一致,用 rGDF11 对老化卫星细胞的分化培养物进行体外处理后,多核肌管的数量增加,表现出更高的线粒体含量和增强的线粒体功能。最后,我们观察到在 rGDF11 治疗的老年动物未受伤的骨骼肌中自噬体(巨自噬)标志物的基础水平增加(评估为自噬中间体 LC3-II 与 LC3-I 的比率)。总的来说,这些数据表明自噬/线粒体自噬和线粒体生物发生的增强可能是 rGDF11 治疗的老年小鼠肌肉纤维细胞重塑的可能解释。
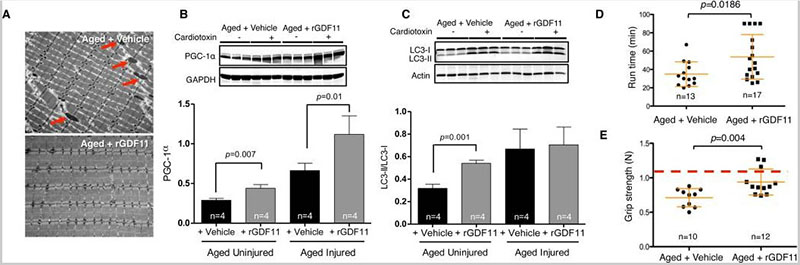
图 3
补充 rGDF11 后肌肉生理机能和身体机能得到改善
(一)。来自媒介物或 rGDF11 处理的老年小鼠的 TA 肌肉横切面的电子显微照片(每组 n = 4 的代表)。箭头表示肿胀的线粒体。(乙,丙)。PGC-1α (B) 和 LC3 型 I 和 II (C) 在来自心脏毒素损伤或未损伤的载体或 rGDF11 处理的老年小鼠的 TA 肌肉提取物中的蛋白质印迹。每个实验组显示三只动物。在每个印迹下方提供了蛋白质密度计量定量,归一化为 GAPDH (B) 或肌动蛋白 (C)。(D, E). 车辆或 rGDF11 治疗的老年小鼠的运动耐力(D,90 分钟窗口内的最大跑步机运行时间)或前肢抓地力 (E) 的散点图。握力被绘制为在三次重复试验中施加的最大力(牛顿,N)。红线代表 33-39 周大的年轻雄性小鼠的最大握力。数据显示为单个小鼠(黑色符号)与平均值 ± SD(橙色线)重叠。p值通过Mann-Whitney分析计算。“n=”表示用于每次分析的小鼠数量。
我们接下来质疑 rGDF11 治疗的老年小鼠肌肉超微结构和线粒体更新的改善是否可能转化为运动耐力和握力分析中身体功能的改善。尽管个体动物的反应存在差异,但用 rGDF11 治疗的老年小鼠表现出平均运动耐力增加(35 分钟 vs. 57 分钟)。在剧烈跑步 40 分钟后,rGDF11 处理的动物还表现出改善的全身乳酸清除率和较低的葡萄糖水平,提供了间接支持改善的老年 rGDF11 处理动物线粒体功能的额外证据。最后,与 rGDF11 刺激的肌纤维超微结构重塑一致,rGDF11 治疗的动物表现出增加的平均握力。无花果。3E和S15 )在标准化测试平台中。
我们在此报告的研究将 GDF11 确立为年轻再生潜力的新型体液调节剂,并证明该因子对老化卫星细胞功能的恢复与累积 DNA 损伤的逆转一致。这些数据表明,基因组毒性可能会限制衰老肌肉中的干细胞功能,如先前报道的造血系统。然而,越来越多的证据表明,干细胞中的 DNA 链断裂可能不仅是基因组损伤的结果,也是核重编程以允许细胞分化的保守和必要事件。年轻和老年肌肉干细胞的转录组分析表明,一些肌肉分化基因在老年卫星细胞中上调,尽管老化细胞显示出受损的再生能力 。此外,我们未能通过免疫荧光分析检测到与年龄相关的 DNA 损伤识别和修复酶表达的变化。这些数据增加了老化卫星细胞显示 DNA 损伤明显增加的可能性,因为它们在肌生成的早期阶段被阻止,其中分化相关的 DNA 链断裂已被诱导但未解决。扩展这一逻辑,通过联体共生或 rGDF11 治疗进行的全身性“复兴”可能会从这种年龄诱导的分化块中释放这些细胞。这一观点与我们的数据一致,表明老化卫星细胞中 DNA 损伤的检测增加和活化的 cleaved-Caspase3 增加, 在“恢复活力的”肌肉中恢复生肌活动后这些变化的解决。在体外与rGDF11处理以增加肌细胞数量和促进肌管老年卫星细胞(培养物形成图S19和S13A)。鉴于 rGDF11 刺激老化卫星细胞的复兴与老化卫星细胞生态位的重塑相吻合。我们推测老年小鼠 GDF11 水平的增加可能直接和间接地恢复卫星细胞再生功能,刺激卫星细胞分化能力的内在变化并产生更多的“promyogenic”生态位,外在支持内源性再生和移植相关的肌原性植入。
GDF11 属于一个保守的生长因子家族,可调节多种细胞过程 。小鼠中 GDF11 的遗传缺陷会导致严重的发育异常,包括肾脏发育不全和围产期致死率。GDF11 的成熟形式与 MSTN 具有约 90% 的序列同一性,MSTN 以其对骨骼肌质量的强大负面影响而闻名,并结合相同的受体 (ACVR1B/ALK4、ACVR1A/ALK5 和 ACVR1C/ALK7) 。先前的一项研究报告称,出生后 (P12) 卫星细胞的 ALK4/5 表达水平相对较低,并且未能检测到这些细胞在暴露于 MSTN 后的增殖差异。我们发现老化的卫星细胞在体外暴露于 rGDF11,而不是重组 MSTN 或 TGF-β1,导致细胞增殖和分化的剂量响应性增加,表明 GDF11 与 MSTN 不同,可以直接作用于卫星细胞以改变它们的功能。有趣的是,生长促进可能是 MSTN/GDF11 的主要作用,因为无脊椎动物只拥有 MSTN/GDF11 家族的单一直系同源物,而该基因的下调会导致生长迟缓 。无论如何,rGDF11 在骨骼肌中的促生肌作用、心脏中的抗肥大作用的独特组合,以及对老年小鼠神经发生和神经元功能的有益影响,应该鼓励进一步研究其对各种年龄相关疾病的治疗潜力,并表明 GDF11 应被视为哺乳动物衰老的新分子调节剂,具有潜在的广泛的应用。
致谢
我们感谢 HSCI/HSCRB 流式细胞术核心、哈佛大学生物成像中心以及 C. Dall'Osso 和 B. Hunter 的技术援助。这项工作是由美国心脏协会的补助部分资金,以FSL(博士后),美国国立卫生研究院(R01 AR42238)以到丽江,格伦基金会的医学研究,哈佛干细胞研究所和美国国立卫生研究院(1R01 AG033053,1DP2 OD004345和5U01 HL100402 ) 到 AJW,NIH (R01 AG032977 1R01 AG040019 ) 到 RTL 和 Project Ascelegen 到 AJW 和 RTL。AJW 是霍华德休斯医学研究所的早期职业科学家。一些作者有与这项工作相关的未决专利申请。
