年轻系统因素对衰老小鼠大脑的血管和神经源性复兴
抽象的
在成人中枢神经系统中,神经源性生态位的脉管系统通过提供循环和分泌因子来调节神经干细胞的行为。与年龄相关的神经发生和认知功能下降与血流量减少和神经干细胞数量减少有关。因此,恢复生态位的功能应该可以抵消衰老的一些负面影响。我们表明,在年轻血液中发现的因素会诱导血管重塑,最终导致衰老小鼠的神经发生增加和嗅觉辨别力改善。此外,我们表明单独的 GDF11 可以改善脑血管系统并增强神经发生。
在成人大脑中,神经干细胞位于一个三维异质生态位,在那里它们与血管和脑脊液直接接触。脉管系统可以通过提供内皮细胞分泌的信号分子的局部来源 以及传递全身调节因子 来影响神经干细胞的增殖和分化。催乳素激素 、饮食限制 和运动/丰富的环境 会积极调节神经发生,而与压力相关的糖皮质激素水平升高则具有相反的效果 ( 6))。在老化小生,在血流量(随之减少脉管劣化7),和神经干细胞的下降的神经原性潜力,导致降低的神经可塑性和认知(8 - 10)。全身性因素也会影响这些衰老相关事件,无论是循环单核细胞增强老年小鼠髓鞘再生的积极作用,还是衰老血液中趋化因子的积累可以减少年轻小鼠的神经发生和认知能力的消极作用 。
为了测试外在年轻信号是否可以恢复神经源性生态位的年龄相关衰退,我们使用了小鼠异时共生模型。我们的实验揭示了老年脑血管系统对年轻全身性因素的反应发生了重塑,产生了明显更大的血流量,以及脑室下区 (SVZ) 神经干细胞增殖的激活和嗅觉神经发生的增强,从而导致嗅觉功能的改善。此外,我们测试了 GDF11,它是一种循环 TGF-β 家族成员,可逆转老年小鼠的心脏肥大,发现它还可以刺激衰老小鼠的血管重塑并增加神经发生。因此,我们观察到该生态位的年龄依赖性重塑通过系统干预是可逆的。
为了验证我们的假设,我们在 15 个月大的 (Het-O) 和 2 个月大的 (Het-Y) 雄性小鼠以及年龄匹配对的对照组,即等时幼鼠 (Iso-Y )和等时旧(Iso-O)对(图S1)。在国家衰老研究所的生长条件下,这种小鼠品系的平均寿命为 27 个月。所有的parabiotic对保持手术连接5周(14)。因为老化导致的祖细胞的数量减少(15 - 17),我们评估了异时联体如何影响神经SVZ通过分析冠状SVZ部分干细胞群(Fig.S2A) 不同 SVZ 干/祖细胞类型的异时和等时大脑,如增殖性 Ki67 +细胞、Sox2 +干细胞和 Olig2 +转运放大祖细胞 (图1A、B、C分别)。这些切片的定量显示 Ki67 +细胞增加了 26.9% (图S2B),Sox2 +细胞增加了112% (图1D) 和 57% 对于 Olig2 +细胞 (图1E) 在 Het-O 中与 Iso-O SVZ 相比。然而,这些细胞群在 Het-Y 小鼠中不受影响(图S2C和图 1 D、E)。老血中的全身性因素会对幼龄动物的海马神经发生产生不利影响 ;然而,我们发现与 15 个月大的伴侣结合的年轻小鼠的 SVZ 中的神经干/祖细胞数量没有减少。我们想知道这种差异是否与 SVZ 和海马体之间的差异有关,或者与我们的老动物比之前研究中使用的老动物年轻这一事实有关。因此,我们将 2 个月大的小鼠与 21 个月大的小鼠(图S3A)结合在一起,发现较老的血液对年轻的 SVZ 神经发生产生负面影响,因为 Het-Y 21小鼠表现出增殖 Ki67 +减少(图S3B、D)和Sox2 +细胞群(图S3C、E )在SVZ中与Iso-Y小鼠相比。这些数据与先前报道的老年血液对海马神经发生的负面影响一致 ,并表明老年小鼠血液中影响海马和 SVZ 神经源区的因素的年龄依赖性积累。
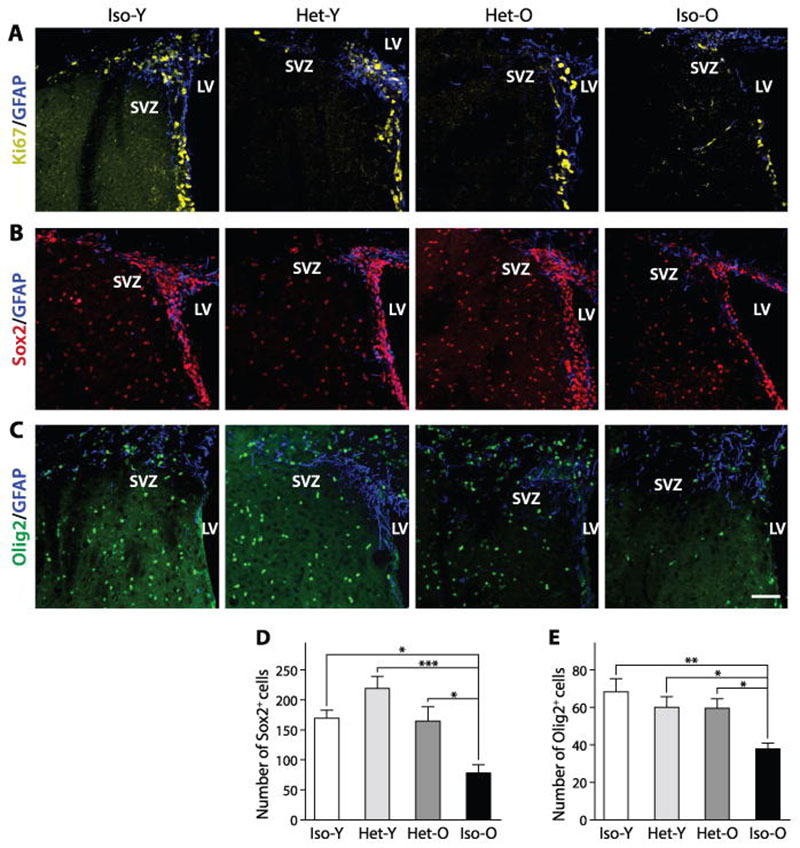
图。1
异时共生对祖细胞的再生
( AC ) 共聚焦图像显示共生对等时和异时小鼠 SVZ 中的增殖 (A)、神经干细胞 (B) 和祖细胞 (C) 的影响。比例尺:50μm。( DE)上述图像的神经干 (D) 和祖细胞 (E) 种群的量化(每个实验组 n=9 只动物,*p<0.05,**p<0.01,***p<0.001)。数据显示为平均值±SEM;通过 ANOVA 进行统计分析。
老化导致从 SVZ 分离的前体细胞中的细胞周期时间更长。为了评估异时共生对神经干细胞增殖的影响,我们培养了来自共生大脑的神经干细胞作为神经球 。第一次传代后,源自 Het-O SVZ 的神经球的直径比源自 Iso-O SVZ 的神经球直径大 43%(图 S4),并且在去除生长因子后,它们产生的 TuJ1 +增加了约 2.5 倍神经元比 Iso-O(图 S5)。这表明暴露于年轻全身因子的神经干细胞增加了它们增殖和分化为神经元的能力。总的来说,这些数据表明年轻的循环因子可以恢复老化的 SVZ 干细胞的自我更新和分化潜力,并且这种效果在从小鼠大脑中分离后可以持续一段时间。
成年 SVZ 神经干细胞和祖细胞分化成神经母细胞,并通过嘴部迁移流迁移到嗅球,在那里它们成熟为中间神经元。我们询问神经干细胞和祖细胞的增加是否会导致 Het-O 小鼠嗅觉神经发生的后续变化。我们用 BrdU 脉冲共生对标记新生神经元,3 周后分析小鼠的 BrdU + / NeuN +细胞以量化新生神经元。图2A)。正如我们的体外研究所预期的那样,我们观察到体内嗅觉神经发生增加。与 Iso-O 群体相比,Het-O 新生神经元群体富集了 92%(图 2B)。根据我们的上述结果,Het-Y 小鼠的新神经元数量仅受到轻微的负面影响,尽管减少没有统计学意义(图 2C)。

图2
异时共生增强衰老小鼠的神经发生和认知功能
(A)嗅球的代表性图像,显示等时和异时生物中的新生神经元。比例尺:100μm。高倍率插入中的圆圈表示 BrdU + /NeuN +双阳性细胞。( B, C ) 老 (B) 和年轻 (C) parabionts 嗅球中神经发生的量化。(n=4,*p<0.05)。( D ) 在嗅觉灵敏度测定过程中测量探索时间 (n = 3)。数据显示为平均值±SEM;通过 t 检验进行统计分析。“n=”表示每个实验组的动物数量。
为了测试这些发现的功能意义,我们进行了一项嗅觉测定,其中 5 周后与它们的 parabiotic 伙伴分离的幼稚单一 parabionts 暴露于不同浓度的气味 。在短暂的适应期后,每个 parabiont 都被呈现不同浓度的气味,并测量了每个 parabiont 探索每个浓度的气味所花费的总时间。在该测定中,Het-O (图 2D) 和年轻对照 (图 2D) 小鼠都花更多时间探索低浓度的气味剂(稀释 10 5倍),而高浓度(稀释 10 倍)产生负面反应。相比之下,无论浓度如何,Iso-O 小鼠探索气味的时间大致相同。图 2D)。这些结果表明 Het-O 小鼠比 Iso-O 小鼠具有更高的嗅觉辨别力。因此,将神经源性生态位暴露于年轻的全身因素可增强功能性神经发生,最终改善嗅觉行为。
脑血管结构,毛细血管密度和脑血流量已报告的下降与老龄化(23 - 25)。鉴于脉管系统和神经干细胞之间的相互联系,我们询问年轻血液因子是否也可以使血管结构和功能恢复活力。为了测试这一点,我们创建了“血管造影照片”,即血管的 3D 重建(图 S6A)。这些血管造影的体积分析表明,正如预期的那样,衰老会导致血管体积减少。图 3A、B)。然而,异时共生逆转了这种下降,与 Iso-O 组相比,Het-O 组的血管体积增加了 87%。图 3A、B)。此外,我们观察到 Het-O 与 Iso-O 小鼠的血管分支增加了 21%(图 S6B)。Het-O 小鼠的一些血管与 AQP4 +星形胶质细胞尾足无关,表明这些血管是新形成的并且可能渗漏,从而为 NSC 提供增强的营养支持(图 S6E)。Het-O 小鼠的这种血管重塑现象扩展到其他神经源性区域,如海马(图 S7A、B)以及非神经源性区域,如皮质(图 S7C)。为了测试增加的血管体积是否导致功能改善,我们通过磁共振成像(MRI)测量了parabiotic小鼠的脑血流量(CBF)。图 3E),因为已知 CBF 会随着年龄的增长而减少 。我们发现异时共生确实将 CBF 恢复到年轻动物的水平。图 3C,德),表明在 Het-O 小鼠中观察到的血管重塑改变了中枢神经系统血管系统的血流动力学。相反,年轻的脉管系统保留了相同的体积(图 3A、B)、等时和异时共生中的血流(图 S6D)和分支(图 S6C)特征。
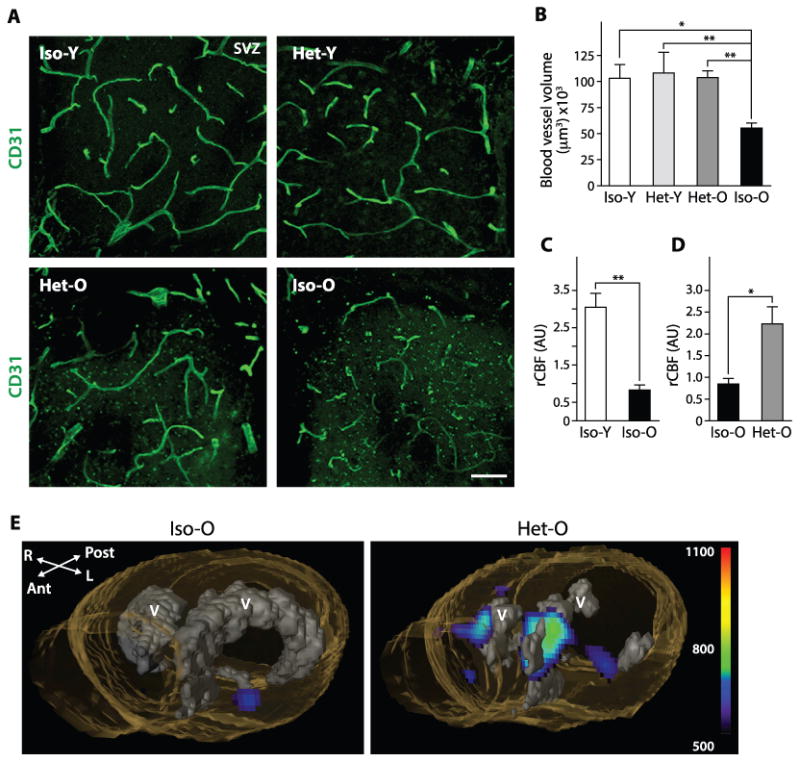
图 3
年轻的血液诱导血管重塑并增加老年小鼠的血流量
( A ) SVZ 区域的共聚焦图像显示异时共生后脉管系统的变化。比例尺:50μm。( B ) 等时和异时生物中血管体积的测量 (n老= 9, n年轻= 6)。( C, D ) parabionts SVZ 区域脑血流量的测量:Iso-O 与 Iso-Y (C) 或 Het-O (D) 小鼠 (n = 4)。(E)大脑的灌注 MRI 图像。“V”表示心室。数据显示为平均值±SEM;(B) 中的方差分析和 (C, D) 中的 t 检验;*p<0.05,**p<0.01,***p<0.001。“n=”表示每个实验组的动物数量。
新血管可以通过从现有毛细血管发芽或从循环内皮祖细胞从头形成。为了测试这些机制中的哪一种正在发生,我们将年轻的 GFP 小鼠与年老的非 GFP 小鼠结合了 5 周。对这些大脑的分析排除了年轻循环内皮祖细胞对 Het-O 动物血管重塑的任何可检测贡献(图 S8)。由于周细胞在毛细血管的血管收缩中起作用,我们试图调查它们的数量是否因异时共生而改变。与血管相关的周细胞数量不受联体共生的影响(图 S9)。当我们培养原代小鼠脑毛细血管内皮细胞并用从年轻或年老小鼠中分离的血清处理它们时,系统性因素可以直接作用于内皮细胞的可能性得到进一步支持。与旧血清相比,年轻血清刺激了 88% 的内皮细胞增殖(图 S10)。
几个因素,包括音猬因子,红细胞生成素,一氧化氮,Notch配体,成纤维细胞生长因子和血管内皮生长因子(28 - 31),影响神经发生也参与血管维护和增殖。与我们的研究最相关的是那些随着年龄增长而减少的因素。最近,发现一种这样的因子 GDF11/BMP11(BMP/TGF-β 家族的循环成员)在年轻和异时老年小鼠血清中的浓度高于老年小鼠血清。对老年小鼠施用 GDF11 再现了联体共生对衰老肥大心肌的许多有益影响(13)。这促使我们测试 GDF11 是否还可以恢复与年龄相关的神经发生下降并参与血管重塑。为此,21-23 个月大的小鼠每天注射重组 GDF11(rGDF11,0.1mg/kg 小鼠体重),一种将老年小鼠的 GDF11 水平提高到年轻水平的给药方案,或 PBS (车辆) 4 周,随后使用上述体积测定分析它们的血管。与 PBS 处理的小鼠相比,GDF11 处理的老年小鼠的血管体积增加了 50%。图 4A、C)。此外,与对照组相比,GDF11 处理的老年小鼠的 Sox2 +细胞数量增加了 29%。图 4B、D)。
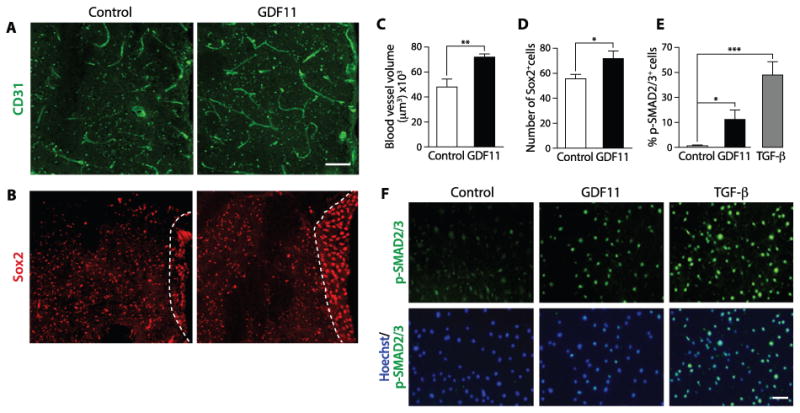
图 4
GDF11 增强血管重塑和神经发生
(A,B)冠状 SVZ 切片的共聚焦图像显示,与对照相比,注射 rGDF11 4 周的 22 个月大的小鼠具有增强的血管化(A)以及增加的 Sox2 +神经干细胞群(B)。( C ) rGDF11 治疗和对照小鼠 (n=9) 血管体积的测量。( D ) SVZ 区域Sox2 +细胞的定量(n=6);“n=”表示每个实验组的动物数量。( E, F ) 磷-SMAD2/3 +百分比的量化 (E) 和代表性图像 (F)在原钒酸钠存在下用 GDF11 (40ng/ml) 或 TFG-β (10ng/ml) 处理原代脑毛细血管内皮细胞培养物中的细胞,用于抑制磷酸酶活性 30 分钟 (n=7)。比例尺:100 μm。数据显示为平均值±SEM;通过 t 检验进行统计分析,在每个实验条件和未处理的对照之间,*p<0.05,**p<0.01,***p<0.001。
体外实验证实 GDF11 至少部分作用于脑毛细血管内皮细胞。首先,用 rGDF11 (40ng/ml) 处理内皮细胞会激活这些细胞中众所周知的 TGF-β 信号通路,这通过 SMAD 磷酸化级联反应的增加来揭示。图 4E、F)。其次,与对照相比,用 rGDF11 (40ng/ml) 对原代脑毛细血管内皮细胞进行 6 天处理后,它们的增殖增加了 22.9%(图S11),但在 TGF-β 抑制剂存在的情况下则不然(图S12) ),证实 GDF11 通过 p-SMAD 途径对这些细胞具有直接的生物学效应。
大脑的生理机能与衰老过程中的脉管系统密切相关。在正常脑存在着密切的神经干细胞和血管的刺激之间的关联SVZ(4 - 6和齿状回)。在这里,我们表明异时性共生增加了神经发生并改善了神经源性生态位的血管分布和血流。GDF11,一种还能使老年小鼠的心脏和骨骼肌恢复活力的因子(35),还能够增加老年小鼠的血流量和神经发生。它的影响不如联体共生本身那么大,尽管这可能与使用次优剂量的该因子有关。此外,它的一些行为可能是直接的,而另一些可能是间接的。需要额外的实验来解决这个问题。
我们工作中提出的一个问题与衰老相关的积极和消极循环因素的平衡变化有关。我们在此表明,来自 15 个月大小鼠的血液对年轻小鼠没有不利影响,而年龄较大的血液(21 个月大)会显着减少年轻大脑中的神经干细胞数量,这种影响也在海马体中观察到 . 这一观察结果表明,存在有害全身因素积累和/或年轻因素减少的年龄。然而,不管老大脑的年龄如何,我们和其他人已经表明,年轻的血液仍然能够使老大脑恢复活力。
总之,循环因子,特别是 GDF11,对衰老小鼠具有多种积极作用,包括增强神经发生。有趣的是,衰老也会影响大脑非神经源性区域的微血管网络 。循环因子改善了皮层以及衰老小鼠大脑其他部分的脉管系统。血流量增加可能会导致神经活动和功能增加,从而为治疗与年龄相关的神经退行性疾病开辟新的治疗策略。
致谢
我们感谢 HSCRB 组织学核心的 McGillivray 女士和 Faria 女士提供切片帮助,以及 HCBI 的 Smith 先生和 Götze 博士提供显微镜设施。我们还要感谢 W. Stallcup 教授提供抗 NG2 抗体、Bonal 博士提供技术帮助和 J. LaLonde 女士提供编辑协助。这项工作得到了埃里森医学基金会颁发的老年学高级学者奖给 LLR、葛兰素史克和哈佛干细胞研究所颁发给 LLR、NIH (R01 AG032977 1R01 AG040019 ) 到 RTL 和 Paul F. Glenn 医学研究基金会的支持、NIH(1R01 AG033053、1DP2 OD004345 和 5U01 HL100402)和哈佛干细胞研究所到 AJW。
